私たちのからだは、60兆個もの細胞から構成されていますが、常にそれぞれの細胞に与えられた役割を十分に果たすことができるように、細胞には寿命があって常に新しい細胞と入れ替わりながら生体を維持しています。
また、怪我をした時などは特にこの機能が働き傷を修復してくれます。この仕組みを保つためには、新しい細胞を生み出し、補充する役割を持つ細胞が必要となります。この細胞を「幹細胞」といいます。幹細胞のお蔭で私たちは生体を維持していくことができるのです。
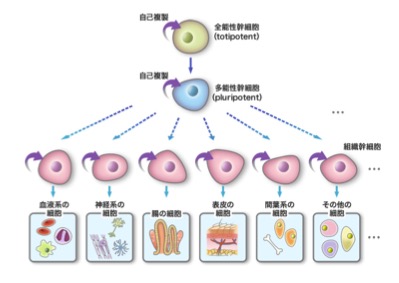
幹細胞には様々な種類がありますが、大きくは2つに分けられます。
人工的に作られた多能性幹細胞
一つは、受精卵から人工的につくられたES細胞(胚性幹細胞)のように、どんな細胞にもなることのできる能力をもった「多能性幹細胞」です。また山中伸弥博士が発見したiPS細胞は生体で既に組織として役目を果たしている細胞をもとにして人工的に作製された「多能性幹細胞」の一つです。
ゴールドスタンダードのES細胞
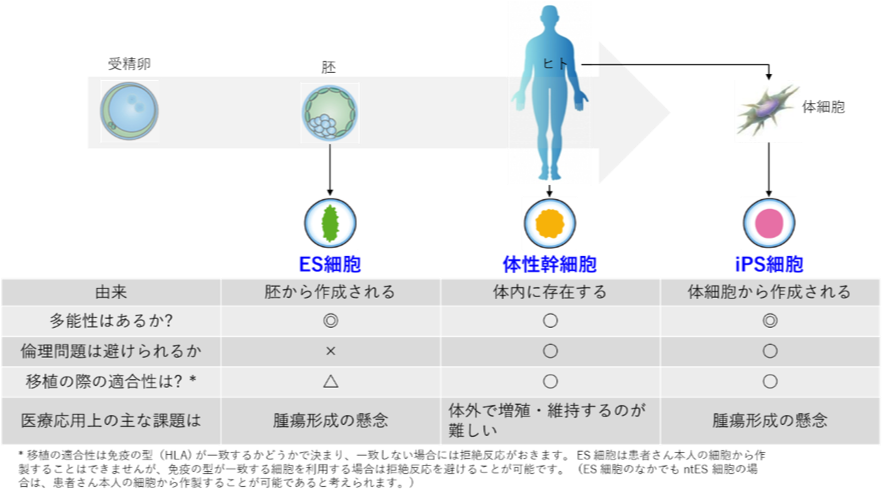
ES細胞は胚性幹細胞と言い、受精卵が分裂を数回経た胚と呼ばれるものの一部を取り出して半永久的に増やすことができる(樹立)状態にしたものです。受精卵から作られるため幹細胞のゴールドスタンダードともいえますが、生命のもととなる受精卵を使うことから倫理的な問題があります。また、ES細胞やそこから分化誘導した細胞や組織は、移植を受ける患者さんから見ると他人の細胞(他家といいます)であるため、臓器移植の際に適合性(免疫拒絶反応)の問題は避けられません。
日本が誇るiPS細胞
iPS細胞は患者さんの細胞(自家といいます)をもとにして作ることができるため、倫理的な問題や適合性の問題は生じませんが、現在の技術では多大な費用と長い時間必要とします。そこで現在は、他家由来のiPS細胞を実用化するための研究が進められています。
他家の細胞でも移植を受ける患者さんと細胞の血液型とも言われるHLA(ヒト白血球抗原)の型を合わせることで、拒絶反応を抑制することができることが分かっています。そこで様々なHLA型のiPS細胞のバンクが作られ、他家由来のiPS細胞の実用化に向けた研究が進んでいます。2017年2月には他家由来のiPS細胞から作成した網膜色素上皮細胞の移植が話題になりましたが、今後ますます実用化に向けた研究が加速すると思われます。
また、「多能性幹細胞」に共通の問題として腫瘍形成の懸念等安全性に関することが挙げられますが、解決策として未分化の幹細胞を取り除く方法の開発など課題の克服に向けた取り組みが進められています。このように将来が期待される多能性幹細胞ですが、現状は様々な課題を克服するための研究の段階であり、臨床試験(治験)が開始されて患者さんの治療に使えるようになるにはまだ相当の時間が必要だと考えられます。
実用化でリードする体性幹細胞
もう一つは生体内に存在して生体を維持するために新しい細胞を補充している「体性幹細胞」です。体性幹細胞はどんな細胞にもなれるわけではなく、血液系の細胞を作るための造血幹細胞、神経系をつくる神経幹細胞というように役割がある程度きまっていると考えられてきました。
間葉系(かんようけい)幹細胞への期待
しかし、骨髄や脂肪組織などに複数の組織を分化できる能力を持っている「間葉系(かんようけい)幹細胞」が存在することが分かり、細胞治療のソースとして大きな期待が寄せられています。「多能性幹細胞」と比べると、分化できる範囲は限定されますがもともと生体内に存在していたことから安全性の面での懸念が極めて少ないことが大きな特徴です。また間葉系幹細胞は生体外に取り出して増やす(培養といいます)技術も開発され、ここ数年で臨床現場での実用化に向けた臨床試験(治験)も増え開発競争が加速しています。ごく一部ですが、間葉系幹細胞をつかった細胞薬として国に認可された製品も上市されており、実用化の面では多能性幹細胞を大きくリードしていると言えます。
参考
SKIP
